Предыстория и дизайн исследования
Ретатрутид (LY3437943) – это новый препарат, состоящий из одного пептида, который активируеттри рецептора одновременно: ГИП, ГПП-1 и глюкагон. Для оценки эффективности и безопасности препарата у лиц с ожирением, но без диабета, было проведено рандомизированное двойное слепое плацебо-контролируемое исследование 2 фазы (NCT04881760). Всего338 участниковПациенты с ИМТ ≥30 или ≥27, имеющие по крайней мере одно сопутствующее заболевание, связанное с весом, были рандомизированы для получения плацебо или ретатрутида (1 мг, 4 мг с двумя режимами титрования, 8 мг с двумя режимами титрования или 12 мг), вводимого один раз в неделю подкожно в течение 48 недель.первичная конечная точкабыло процентное изменение массы тела через 24 недели, со вторичными конечными точками, включающими изменение массы тела через 48 недель и категориальные пороговые значения потери массы тела (≥5%, ≥10%, ≥15%).
Ключевые результаты
-
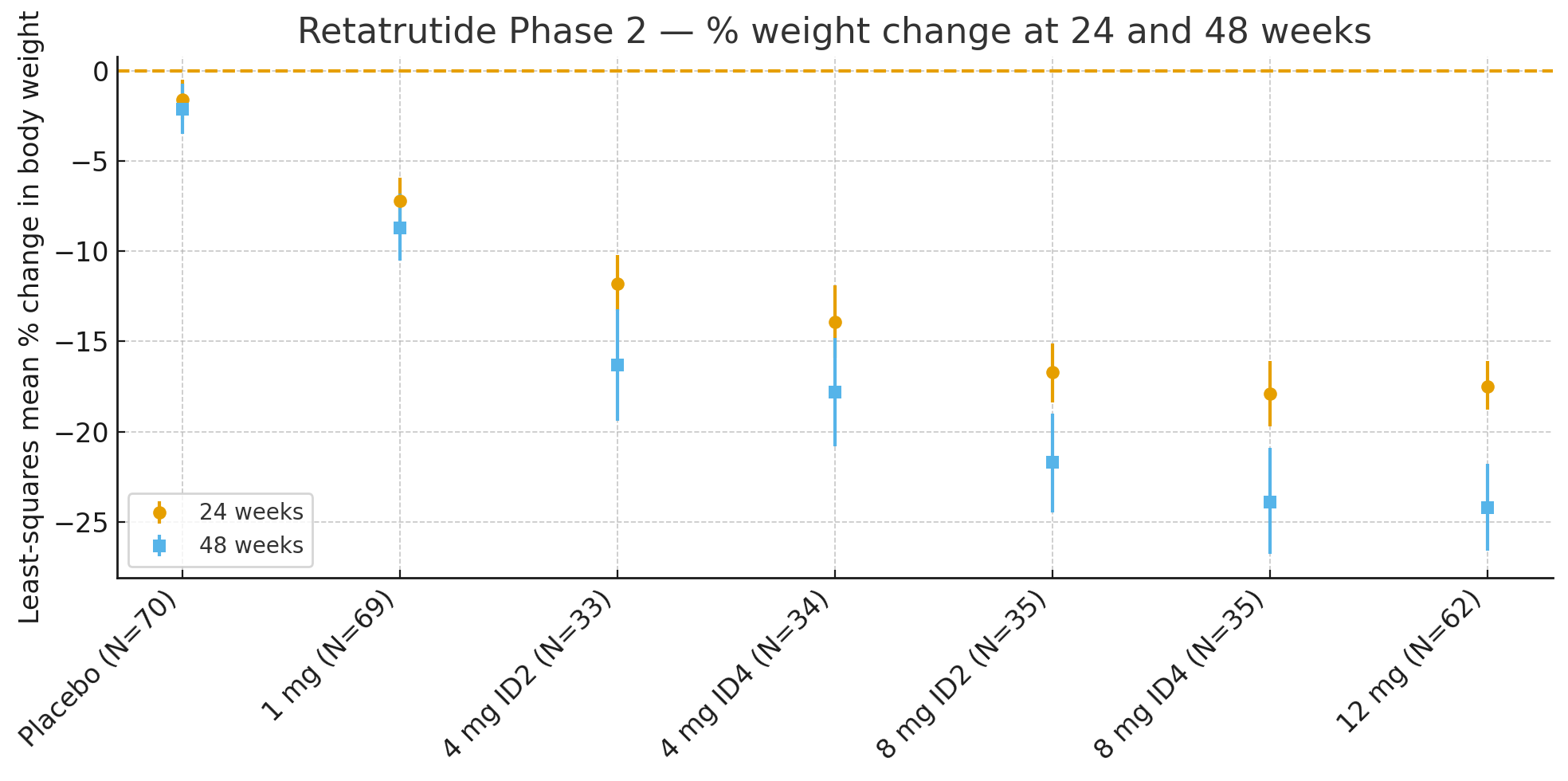
24 недели: Среднеквадратичное процентное изменение массы тела относительно исходного значения составило
-
Плацебо: −1,6%
-
1 мг: −7,2%
-
4 мг (комбинированное): −12,9%
-
8 мг (комбинированное): −17,3%
-
12 мг: −17,5%
-
-
48 недель: Процентное изменение массы тела составило
-
Плацебо: −2,1%
-
1 мг: −8,7%
-
4 мг (комбинированное): −17,1%
-
8 мг (комбинированное): −22,8%
-
12 мг: −24,2%
-
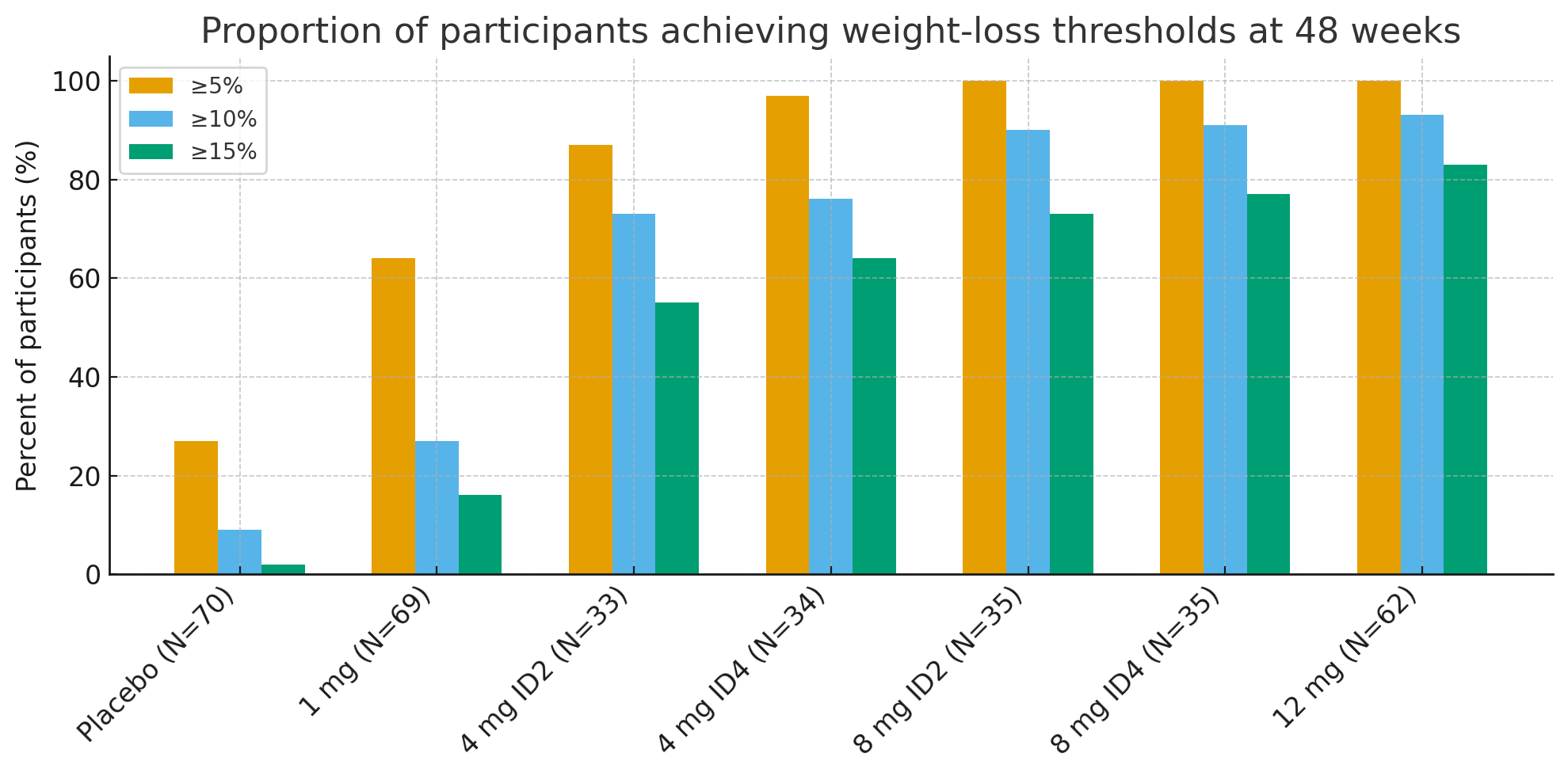
Через 48 недель доля участников, достигших клинически значимых порогов потери веса, была поразительной:
-
Потеря веса ≥5%: 27% в группе плацебо против 92–100% в группах активного лечения
-
≥10%: 9% с плацебо против 73–93% в активных группах
-
≥15%: 2% с плацебо против 55–83% в активных группах
В группе 12 мг до26% участников потеряли ≥30% от своего исходного веса, величина потери веса, сопоставимая с бариатрической хирургией.
Безопасность
Наиболее частыми нежелательными явлениями были желудочно-кишечные (тошнота, рвота, диарея), обычно лёгкой или умеренной степени тяжести и дозозависимые. Более низкие начальные дозы (титрование 2 мг) снижали эти явления. Наблюдалось дозозависимое увеличение частоты сердечных сокращений, достигавшее пика на 24-й неделе, а затем снижавшееся. Частота прекращения лечения в группах активного препарата составляла 6–16%, что несколько выше, чем в группе плацебо.
Выводы
У взрослых с ожирением без диабета еженедельное подкожное введение ретатрутида в течение 48 недель приводило ксущественное, дозозависимое снижение массы тела(среднее снижение массы тела до ~24% при максимальной дозе), а также улучшение кардиометаболических маркеров. Нежелательные явления со стороны желудочно-кишечного тракта наблюдались часто, но поддавались коррекции с помощью титрования дозы. Результаты второй фазы позволяют предположить, что ретатрутид может стать новым терапевтическим эталоном при ожирении, ожидая подтверждения в более крупных и долгосрочных исследованиях третьей фазы.
Время публикации: 28 сентября 2025 г.